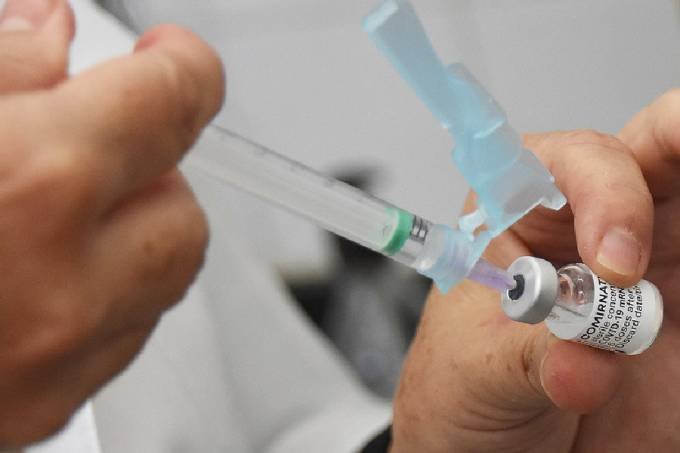
A FDA, agência que regula medicamentos nos Estados Unidos, irá incluir um novo evento adverso raro na bula da vacina contra Covid-19 da Janssen, braço farmacêutico da Johnson & Johnson. Segundo informações do The New York Times, as autoridades federais americanas identificaram cerca de 100 casos suspeitos de síndrome de Guillain-Barré entre os receptores da vacina. Após analisar os casos, eles concluíram que o risco de desenvolver a doença após a vacina é baixo, mas parece ser de três a cinco vezes maior que entre a população em geral.
Diante disso, a agência planeja incluir o problema como um dos possíveis efeitos colaterais raros do imunizante, mas reitera que os benefícios da vacina ainda superam qualquer perigo. A síndrome de Guillain-Barré é uma doença do sistema nervoso que causa paralisia temporária. Considerada de caráter autoimune, ela pode surgir em qualquer momento da vida e ser desencadeada após uma infecção. Seu início também já foi associado a outros imunizantes. A condição é reversível, mas pode deixar sequelas em 20% dos pacientes e matar 5% dos acometidos.
Em comunicado divulgado nesta segunda-feira,12, os Centros de Controle e Prevenção de Doenças dos EUA (CDC, na sigla em inglês) disseram que a maioria dos casos ocorreu cerca de duas semanas após a vacinação e principalmente em homens, muitos com 50 anos ou mais. Até o momento não há relatos entre a síndrome e outras vacinas contra o novo coronavírus, como a da Pfizer-BioNTech ou Moderna. Por outro lado, seis casos da doença foram relatados na Austrália, após a administração da vacina de Oxford-AstraZeneca, que utiliza tecnologia semelhante à da vacina da Janssen. No entanto, ainda não há comprovação de que o imunizante britânico possa causar a doença.
Outros eventos adversos
Essa não é a primeira vez que eventos adversos raros são associados às vacinas contra Covid-19 e incluídos na bula. No início do ano, as vacinas da Janssen e de Oxford-AstraZeneca, feitas a partir de vetor viral, foram associadas a casos raros de trombose. O efeito colateral foi considerado raro, mas incluído na bula e o imunizante passou a ser contraindicado para determinados públicos, como gestantes.
Recentemente, a vacina da Pfizer-BioNTech e a da Moderna, feitas a base de mRNA, foram associadas a casos de miocardite, uma inflamação no coração, e pericardite, inflamação na membrana que envolve o coração, em pessoas jovens. O problema também foi incluído na bula destes imunizantes.
Benefícios superam os riscos
Apesar de todas as descobertas, autoridades de saúde e especialistas são categóricos em afirmar que os benefícios das vacinas aprovadas superam os riscos. “A EMA [agência que regula medicamentos na União Europeia] confirma que os benefícios de todas as vacinas autorizadas contra a Covid-19 continuam a superar seus riscos, dado o risco da própria Covid-19 e de suas complicações, e das evidências científica que mostram que elas [as vacinas] reduzem as mortes e hospitalizações devido à Covid-19″, escreveu a Agência Europeia de Medicamentos, em comunicado publicado na última sexta-feira, 9, após concluir que os casos de inflamação no coração estão associados aos imunizantes de RNA mensageiro.
“A vacina tríplice bacteriana, a tríplice viral e outras vacinas tem vários eventos adversos. Muito mais do que as que a gente está tomando agora. E todo mundo toma [essas vacinas] porque elas salvam mais vidas do que colocam em risco. E nós nunca estivemos tão expostos a risco como estamos nessa pandemia. Não tem que ter dúvida, tem que tomar a vacina”, disse a pesquisadora Sue Ann Costa Clemens, professora da Universidade de Oxford e consultora sênior da Fundação Bill e Melinda Gates, em entrevista à VEJA sobre o assunto.
Recentemente, a Anvisa publicou orientações sobre como notificar eventos adversos raros possivelmente associados à vacina. A agência também explica que as vacinas são seguras, mas como são “tecnologias novas, de produtos inovadores, é dever da autoridade sanitária prezar pelo monitoramento deles para verificar sua segurança e efetividade. Essa ação não surgiu com a pandemia do novo coronavírus. O acompanhamento de produtos para saúde introduzidos no mercado sempre foi feito por uma equipe técnica especializada. É a razão de existir da gerência de Farmacovigilância da Anvisa. Ocorre que, no caso da Covid-19, esse cuidado tem de ser intensificado devido ao uso em larga escala de vacinas de diferentes origens, aplicadas ao mesmo tempo, para imunização de toda a população brasileira”, diz a agência.
Para quem sentiu algum desconforto após a vacinação e acredita que o sintoma pode está relacionado ao imunizante, a recomendação é acessar o sistema eletrônico VigiMed e notificar a suspeita de evento adverso.